Antwort Warum springt der pH-Wert am Äquivalenzpunkt? Weitere Antworten – Warum kommt es zu einem pH Sprung in der Titrationskurve
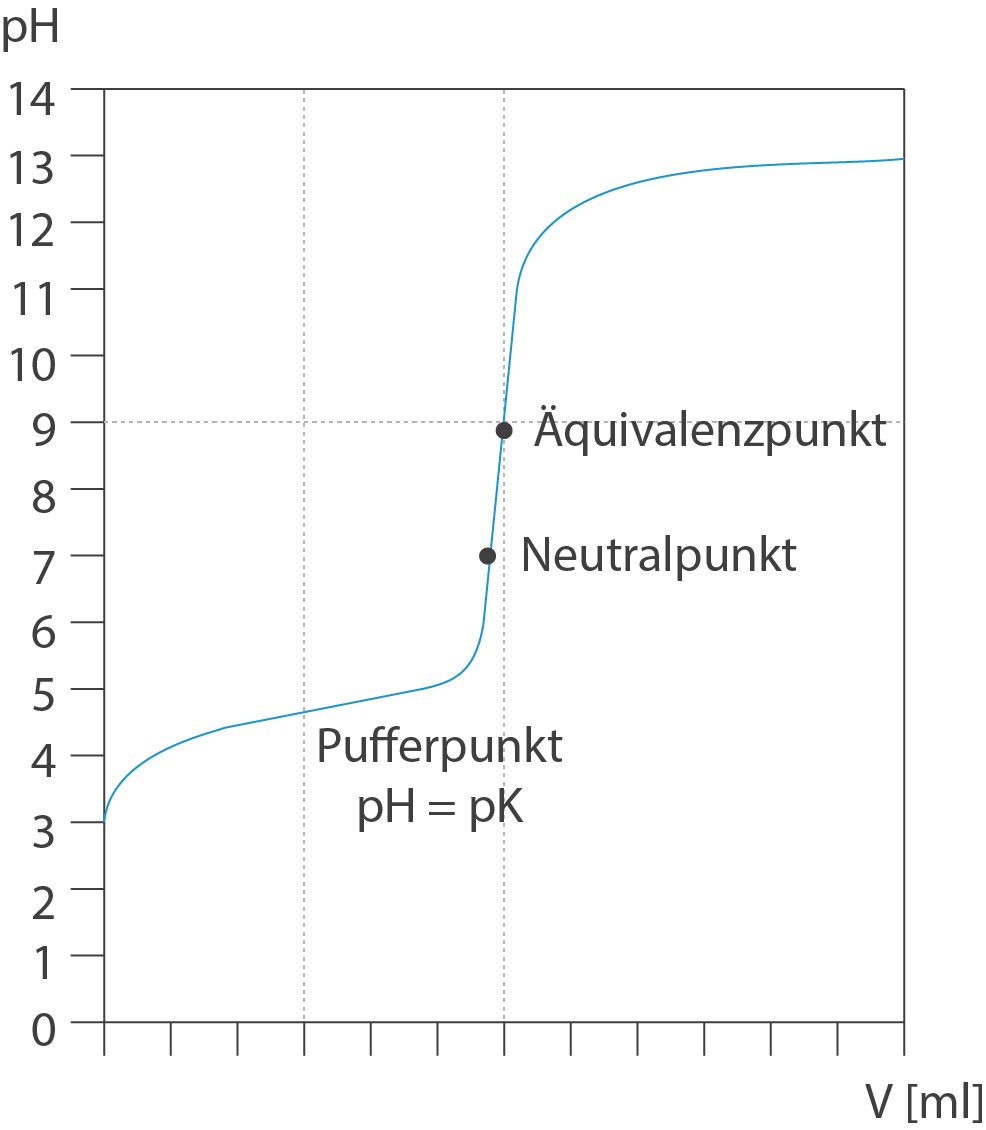
Vor dem Äquivalenzpunkt
Je mehr Hydroxid-Ionen (OH⁻) dazu kommen, desto mehr Oxonium-Ionen werden neutralisiert. Kurz vor dem Wendepunkt sind nur noch wenig Oxonium-Ionen in der Lösung. Daher sieht man einen sprunghaften Anstieg des pH-Wertes.Jedoch liegt dieser Punkt nicht immer bei pH=7, wie man anfangs vielleicht annehmen könnte. Nur bei starken Basen oder Säuren, wie NaOH oder HCl, stimmt dieser Wert. Der Grund hierfür liegt in der Lage des chemischen Gleichgewichts der Säure-Base-Reaktion mit Wasser.Der Äquivalenzpunkt beschreibt den Punkt einer Titration, an dem die Stoffmenge der hinzugegebenen Maßlösung exakt der Stoffmenge an unbekannter Säure bzw. Base entspricht. Die Reaktion der Titration muss aufmerksam beobachtet werden.
Warum beginnt die Titrationskurve der Essigsäure bei pH 3 : Die Titrationskurve startet bei pH 3. Das liegt daran, dass die Säure nur etwa zu einem Tausendstel dissoziiert ist. Die steigt zu Beginn stärker an, um dann in einen Wendepunkt mit flacher Wendetangente einzumünden. Hier wird die undissoziierte Säure unter Zusatz von OH–Ionen zerlegt.
Warum ist der Äquivalenzpunkt nicht immer der neutralpunkt
Vergleich mit Neutralpunkt
Titriert man starke Säuren und Basen miteinander, so ist der Äquivalenzpunkt in wässriger Lösung gleich dem Neutralpunkt, der pH-Wert ist 7. Titriert man dagegen unterschiedlich starke Säuren und Basen miteinander, so ist die entstehende Lösung beim Äquivalenzpunkt nicht neutral.
Wie verändert sich der pH-Wert mit der Temperatur : Mit dem pH-Wert wird der Gehalt an H+-Ionen gemessen. Damit kann bestimmt wer- den, ob das Wasser sauer, basisch oder neutral ist. Der pH-Wert ist temperaturab- hängig: Je höher die Wassertemperatur, desto höher ist generell der pH-Wert, weil sich die Eigenschaften der Teilchen mit der Temperatur verändern.
Wenn du gleich starke Säuren und Basen titrierst, dann ist der Äquivalenzpunkt automatisch der Neutralpunkt, also mit einem pH-Wert von 7.
Je nach pKs oder pKb-Wert des Salzes wird zur Berechnung die Formel für starke oder schwache Säuren oder Basen verwendet. Bei der Titration von starken Säuren oder Basen entstehen nur neutrale Salze. Deshalb ist der Äquivalenzpunkt hier immer bei pH = 7.
Warum stimmen im Falle der Titration von Essigsäure und Natronlauge neutralpunkt und Äquivalenzpunkt nicht überein
Der Äquivalenzpunkt liegt an dem Wendepunkt, an dem die Kurve am stärksten steigt. Hier sind der Äquivalenzpunkt und der Neutralpunkt nicht identisch. Das liegt daran, dass bei der Säure-Base-Reaktion von Essigsäure mit Natronlauge das basische Acetat-Ion entsteht.Diese weist folgende Punkte auf: Neutralpunkt: Menge an Probelösung bei pH-Wert 7. Äquivalenzpunkt: Stoffmenge der Base/Säure entspricht Stoffmenge der Säure/Base und zeigt somit die vollständige Neutralisation.Der Äquivalenzpunkt liegt an dem Wendepunkt, an dem die Kurve am stärksten steigt. Hier sind der Äquivalenzpunkt und der Neutralpunkt nicht identisch. Das liegt daran, dass bei der Säure-Base-Reaktion von Essigsäure mit Natronlauge das basische Acetat-Ion entsteht.
Der pH-Wert gibt an, wie sauer oder basisch (alkalisch) eine Flüssigkeit ist. Er richtet sich nach der Konzentration der Wasserstoff-Ionen in einer wässrigen Lösung. Fällt die Anzahl der Wasserstoff-Ionen, steigt der pH-Wert. Steigt die Anzahl der Wasserstoff-Ionen, fällt der pH-Wert.
Warum schwankt der pH-Wert : Salze setzen sich in Lösung aus Ionen zusammen, die unterschiedlich stark sauer oder basisch reagieren. Auch das Wasser selbst hat je nach Temperatur einen anderen Neutralpunkt: In kaltem Wasser steigt der pH-Wert leicht, bei sehr warmem Wasser sinkt er.
Warum fällt der Äquivalenzpunkt nicht immer mit dem neutralpunkt zusammen : Der Äquivalenzpunkt liegt an dem Wendepunkt, an dem die Kurve am stärksten steigt. Hier sind der Äquivalenzpunkt und der Neutralpunkt nicht identisch. Das liegt daran, dass bei der Säure-Base-Reaktion von Essigsäure mit Natronlauge das basische Acetat-Ion entsteht.
Warum ist Äquivalenzpunkt nicht gleich neutralpunkt
Vergleich mit Neutralpunkt
Titriert man starke Säuren und Basen miteinander, so ist der Äquivalenzpunkt in wässriger Lösung gleich dem Neutralpunkt, der pH-Wert ist 7. Titriert man dagegen unterschiedlich starke Säuren und Basen miteinander, so ist die entstehende Lösung beim Äquivalenzpunkt nicht neutral.
Fällt die Anzahl der Wasserstoff-Ionen, steigt der pH-Wert. Steigt die Anzahl der Wasserstoff-Ionen, fällt der pH-Wert. Reines Wasser hat einen pH-Wert von 7. Niedrigere Werte werden als sauer bezeichnet, höhere als basisch.Das bedeutet, das ein Wasser mit viel Kalzium, also ein hartes Wasser, viel mehr Kohlendioxid enthält als ein weiches Wasser. Deswegen steigt der pH-Wert stärker, schneller und länger an je härter ein Wasser ist. Bei einem weichem Wasser kann es sein, das schon nach einer Woche der pH-Wert stabil bleibt.
Warum steigt der pH-Wert im Pool immer wieder an : Ein pH-Wert-Anstieg über 7,6 kann viele Ursachen haben: Im Füllwasser gibt es (saure) Kohlensäure, die sich durch die Wasserverwirbelung löst und dann ausgast. Aber auch ein unnötig hoher Einsatz von Poolchemie sowie Schmutzeintrag über die Umwelt und Badende können den pH-Wert anheben.